Å finne proteiner med pepperrot
Proteiner utfører mange viktig roller i kroppen og har en finger med i nesten alt som skjer i kroppen. Dette innebærer at nesten alle som forsker på kroppen må forske litt på proteiner. Metodene man bruker for å studere proteiner blir dermed brukt av omtrent alle molekylærbiologer. Den kanskje viktigste av disse metodene kalles for Western Blotting. Meningen med denne prosedyren er å lete etter ett spesifikt protein i en prøve. Jeg gjør dette for å lete etter de to proteinene jeg skal skrive masteroppgaven min om. Metoden kom etter at man hadde funnet en metode for å blotte DNA. Denne metoden ble optimalisert av Edward Southern, som da ga den sitt navn, Southern blot. Som et svar på dette kom da Northern blot, for mRNA, og Western blot for proteiner. Dette er en metode vi bruker en del på labben, og som jeg holder på å lære meg nå.
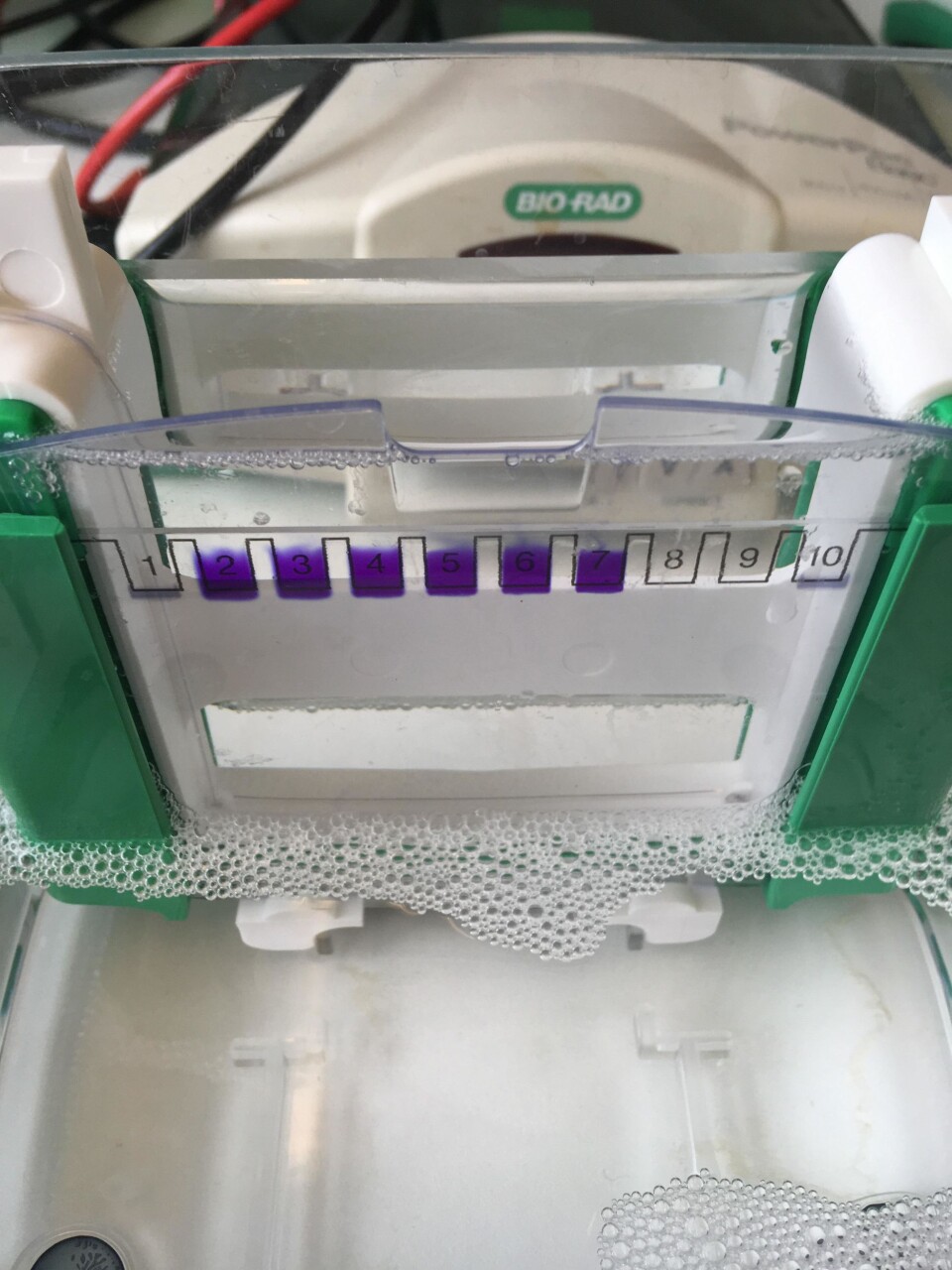
Strømførende gelé
Det første steget i en Western blot er å drepe cellene man har, og sortere ut de store bitene i cellen som man ikke vil ha. Dette blir gjort ved å sentrifugere prøven på veldig høy hastighet, slik at de tunge og store delene detter i bunnen av tuben man har prøven i. Deretter tilsetter man resten av prøven til toppen av gelé, før man så får strøm til å gå gjennom geléen. Dette gjør at proteinene begynner å bevege på seg, fordi proteinene har en ladning. Prøven blir tilsatt på den ene siden av geléen, og vil dermed gå mot den andre siden. Molekylene i geléen lager et nettverk, slik at de små proteinene greier å vandre fortere gjennom geléen enn de store proteinene. Dette gjør at man får spredt proteinene utover og sortert dem etter størrelse. Vi laster også inn det vi kaller for en stige i geléen. Stigen er en prøve man får kjøpt, som inneholder proteiner med kjente størrelser på. Disse proteinene er også tilsatt farge, slik at man kan se hvor langt proteinene har vandret. (hvis man ikke rekker å starte strømmen gjennom geléen før lønsj, så vet man at det blir en lang dag..)

Overføring av proteiner
Når proteinene så er godt spredt utover geléen, så stopper vi strømmen og tar ut geléen. Det er vanskelig å komme til proteinene når de er inne i en gelé, så derfor er neste steg å flytte proteinene til en membran som er laget for å ha proteiner på overflaten. Vi bruker igjen strøm for å flytte på proteinene. Vi har et eget kammer som har elektroder på hver side, slik at proteinene får lyst til å vandre mot den elektroden med motsatt ladning, som sitter like bak membranen. Dermed vandrer proteinene ut av geléen og over på membranen. Dette går betydelig saktere enn å føre proteinene gjennom geléen, dette tar omtrent 3 timer. Da gjelder det å finne noen artikler å lese, eller så kan man jo blogge litt. For å få overført proteinene må man lage en sandwich med papir, så geléen med proteiner, deretter membranen, før man så har enda mer papir. I tillegg er det stålull i hver ende. Fordi vi bruker litt metanol, må vi gjøre alt i et spesielt skap som suger opp luften slik at alt som fordamper blir ført ut av rommet. Man har liten plass inni avtrekkskapet og man må passe på at ikke geléen tørker inn. Alt dette bidrar til å gjøre prosessen knotete.

Hjelp fra mus og kanin
Når vi så har proteinene på membranen bruker vi en saks for å kutte membranen i mindre biter. Det er overaskende vanskelig å kutte rett, selv om man holder membranen med pinsett. Man kan nemlig ikke ta på den, for da kan man overføre støv og gjøre membranen skitten. Fordelen med å kutte membranen i mindre biter er at bruker vi mindre mengder med dyre kjemikalier fordi man ikke trenger å dynke hele membranen. Dette er en måte å spare penger på, samtidig som det er nyttig fordi man da kan lete etter forskjellige proteiner på hver bit. For å lete bruker man antistoff, som er noe immunforsvaret vårt lager for å kjenne igjen fremmede organismer og ting. Antistoffene kjøper vi av firmaer som lager antistoff i dyr. Noen av de vanligste dyrene å bruke er mus og kanin, men blant annet esel og kamel blir også brukt. På min lab legger vi membranbitene i plast, som vi så forsegler slik som mat blir forseglet i butikken: vi smelter plastikken sammen rundt membranbiten. Så lar vi den ligge på en vippe-maskin over natta, slik at antistoffene blir godt spredt rundt.
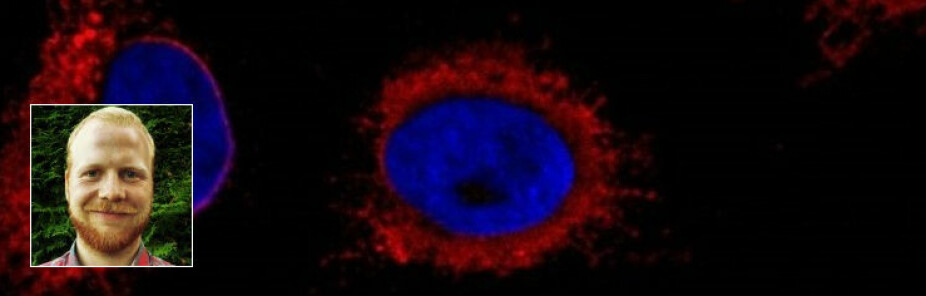
Pepperrot lyser opp
Nå har vi fått festet antistoffene til det proteinet vi håper vi finner på membranbiten. Neste steg er å feste noen andre antistoff på de første antistoffene. Disse sekundære antistoffene er allerede festet til et enzym som kommer fra pepperrot. Når vi tilsetter et spesielt stoff som heter luminol, vil pepperrot-enzymet reagere med det og sende ut lys. Dermed kan vi se hvor proteinene er hen, og vi kan korrelere lysstyrke med mengde protein. Dette er mulig fordi alle disse stoffene er bundet sammen. De aller fleste gangene er lyset så svakt at vi nesten ikke kan se det. Derfor bruker vi en film som er lik de man har i analoge kameraer, til å ta opp lyset. Når vi så fremkaller filmene, får vi fine bånd med proteiner, som man kan se på bildet over. Disse filmene skiller seg fra kamerafilmer ved at de er mye større, de er nemligpå størrelse med et A4-ark. Siden bitene av membraner ofte er mye mindre enn et a4-ark, klipper vi filmene i biter for å utnytte dem bedre. Disse filmene legger vi over membranene i mellom noen sekunder og noen minutter, og så fremkaller vi dem. Vi har faktisk en fremkallingsmaskin på laben!

Støv blir synlig
Hvis man får noe støv på membranen kan fort antistoffene binde seg til dette støvet. Når man så fremkaller filmen vil dette støvet bli veldig synlig, og hvis man er skikkelig uheldig kan det dekke over resultatene man er ute etter. Det gjelder derfor å jobbe rent og bruke rent utstyr og ikke ta på membranene. Selv om vi bruker hansker, er de ikke nødvendigvis rene. Siden de aller fleste molekylærbiologer bruker denne metoden, finnes det også et utall forskjellige metoder å gjøre dette på. Jeg lærer jo min veileders metode, men hvis jeg spør andre på laben får jeg ofte helt forskjellige svar etter hvem jeg spør. Heldigvis er veilereden min sin metode ganske grei.