Leger uten våpen

Tekst: Dag Berild, overlege og professor, Infeksjonsmedisinsk avdeling, Oslo universitetssykehus og Universitetet i Oslo.
Antibiotikaresistens, ingen handling i dag, ingen kur i morgen.
Antibiotikaresistens er i følge Verdens helseorganisasjon (WHO) en av de største helsetruslene i verden.
Ingen medikamenter har reddet flere menneskeliv enn antibiotika, men et stort overforbruk av antibiotika har ført til en global pandemi av antibiotikaresistens.
På tross av dette, utvikles det ikke lenger nye antibiotika. Hvis denne trenden fortsetter er det estimert at det vil dø flere mennesker av resistente bakterier enn av kreft i 2050.
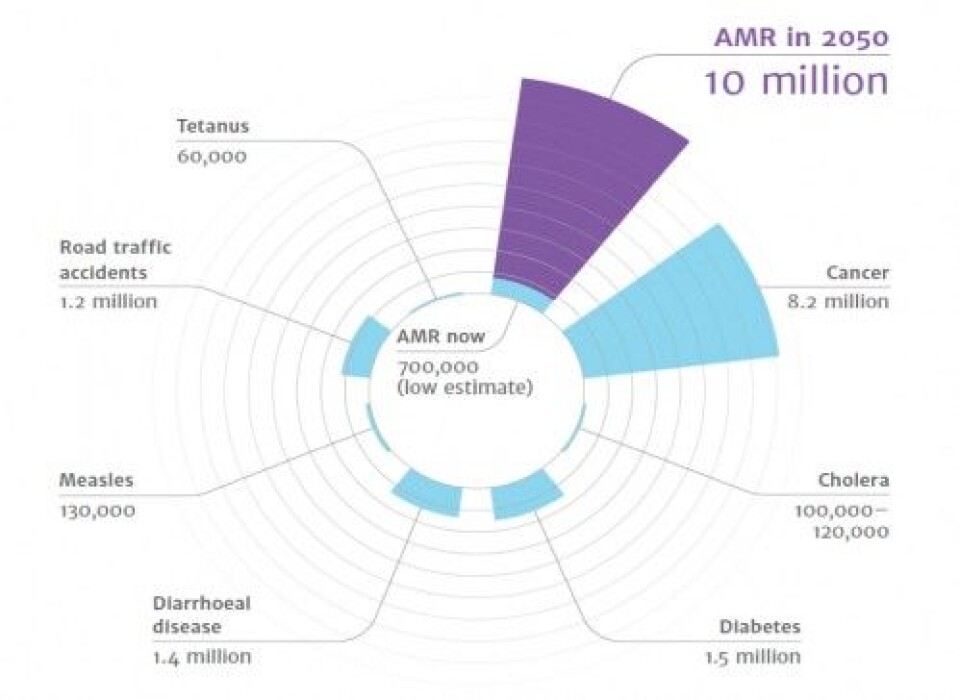
Figur 1. Estimert dødelighet av resistente bakterier (AMR) i 2050. O`Neill J.
Hvorfor blir bakteriene resistente?
All antibiotikabruk kan føre til resistensutvikling som er proporsjonal med forbruket (Figur 2). Når bakteriene påvirkes av antibiotika beskytter de seg ved å endre de sitt arvestoff (DNA) slik at de kan inaktivere antibiotika. Bakteriene blir da resistente, dvs. at antibiotika ikke virker.
De resistente bakteriene kan spres til andre pasienter og ut i omgivelsene. Antibiotika endrer også kroppens normale bakterieflora og selekterer frem sopp og giftige clostridiebakterier som kan forårsake blødende tarmbetennelse. I USA dør 14000 pasienter av Clostridium difficile hvert år.
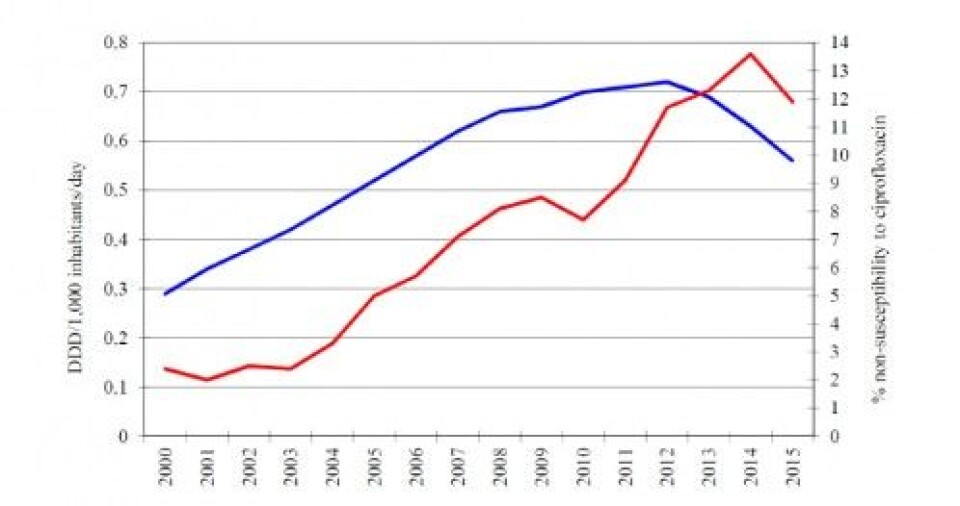
Figur 2. Sammenhengen mellom bruken av ciprofloksacin (blå linje) og ciproxinresistente E. coli (rød linje) bakterier i Norge (NORM).
Hvorfor er det et overforbruk av antibiotika?
All bruk av antibiotika kan føre til resistens, men det er feil bruk som har ført til katastrofen. Før vi fikk antibiotika døde ca. 10 % av alle barn i Europa før de fylte fem år hovedsakelig av infeksjoner.
Da antibiotika kom på markedet for 70 år siden kunne man plutselig kurere dødelige sykdommer som lungebetennelse og blodforgiftning.
Man ekstrapolerte den mirakuløse virkningen på alvorlige infeksjoner til selvbegrensende infeksjoner f.eks. virus og begynte å bruke antibiotika uhemmet. Verst av alt er at antibiotika brukes som vekstfremmere i dyrehold for å øke slaktevekten marginalt. I USA er mere en 70 % av antibiotikabruken på dyr.
I mange lavinnkomstland fås antibiotika uten resept. Dette har ført til et ukontrollert forbruk med påfølgende resistensutvikling.

Eksempler på dette er funn av tarmbakterier som er resistente mot alle antibiotika fra sølepytter i New Dehli og funn av multiresistente bakterier i avføringen hos 57 % av reisende som fikk diaré i India og Mellom-Østen.
Hva er konsekvensene av resistens?
Grovt sett dobles dødeligheten ved resistente bakterier, men den vil øke ytterligere hvis resistensutviklingen fortsetter i samme tempo som nå. Mange vil dø av vanlige infeksjoner slik som i den preantibiotiske æren. Det er nå påvist totalresistent tuberkulose i flere land.
Moderne medisin som protesekirurgi, kreftbehandling og transplantasjoner blir umulig fordi behandling beror på virksomme antibiotika.
Det er ikke kommet nye antibiotika de siste 30 årene, og det er ingen nye i sikte (Figur 3). Det er mere lønnsomt for de farmasøytiske firmaene å produsere medikamenter som pasientene brukes i årevis f.eks. kolesterolsenkere. Det er nå tatt et internasjonalt initiativ for å styrke partnerskap mellom akademia, offentlige institusjoner og farmasøytisk industri for å utvikle nye antibiotika, men det er mange år før dette eventuelt resulterer i nye antibiotika.
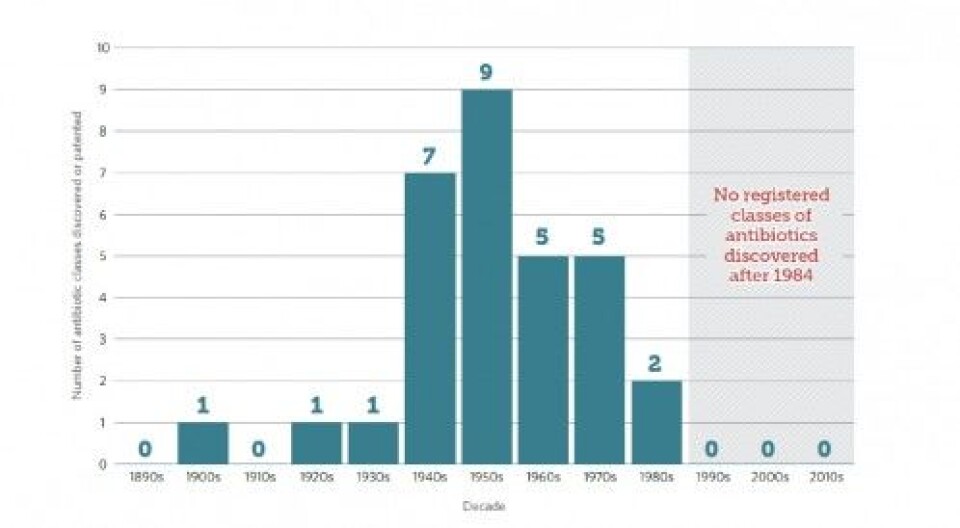
Figur 3: Manglende utvikling av nye antibiotika.
Kostnader
I Europa koster resistens anslagvis 1,5 milliarder Euro per år og et tap av 600 millioner arbeidsdager. I USA koster resistens 21-34 milliarder USD per år og fører til 90000 dødsfall per år (World Economic Forum).
Kostnadene skyldes økt liggetid i sykehus, isolering av pasienter, etc. Pasienter med vanlige infeksjoner som man før kunne behandle med tabletter må legges inn til intravenøs behandling. I tillegg kommer indirekte kostander som produktivitetstap f.eks. tidlig uførepensjonering fordi man ikke kan utføre protesekirurgi, lengere sykefravær etc.
Hvordan har det gått i Norge?
Resistenssituasjonen i Norge var gunstig, men antibiotikabruken har økt betraktelig de siste 20-30 årene med økende resistens til følge (Figur 2). Effektiviseringspress i sykehus, dårlig utdannede og ignorante leger, økte pasientkrav om «å gjøre noe», presseoppslag om kjøttetende streptokokker, «dødsflåtter» etc. kan bidra til at legene overbehandler for sikkerhets skyld.
Overbelegg, korridorpasienter og stresset helsepersonell gjør at hygienen svikter. Det har vært flere epidemien med resistente bakterier i norske sykehus. Det er sannsynlig at reduksjon av sykehussenger og manglende muligheter til å isolere pasienter kan bidra til lettere spredning av resistent bakterier. I tillegg importerer vi resistente bakterier fra høy prevalensland, men, vi vet ikke hvor mye resistens vi importerer og hvor mye vi bidrar selv.
Hva kan vi gjøre i Norge?
Inntil det kanskje kommer nye antibiotika må vi kjøpe oss tid ved å redusere bruken av disse. På den måten kan vi utsette og reversere resistensutviklingen.
Helsedirektoratet har utgitt nasjonale retningslinjer for antibiotikabehandling, men mange leger følger ikke disse. Regjeringen har kommet en handlingsplan mot antibiotikaresistens. Et av målene med planen er at totalforbruket av antibiotika skal reduseres med 30 %.
I sykehusene skal det innføres styringsprogrammer for å redusere bruken spesielt av de bredspektrede resistensdrivende antibiotika. Målene bør være greie å oppnå fordi det er en for stor variasjon i forskrivningsmønsteret for like infeksjoner mellom leger og sykehus. Det er sykehusledelsen som er ansvarlig for at dette gjennomføres, men som vanlig skal tiltakene gjennomføres «innenfor gitte rammer».
Skattebetalerne må uansett ta regningen, og den blir større dess lenge man venter med effektive tiltak. I denne konteksten savner jeg politikere som ikke bare tenker på neste valg, men også på neste generasjon.
Kilder:
O’Neill J. Antimicrobial resistance: tackling a crisis for the health and wealth of nations. Rev Antimicrob Resist. 2014. http://amr-review.org/Publications.
Jorgensen, S.B., et al., High prevalence of faecal carriage of ESBL-producing Enterobacteriaceae in Norwegian patients with gastroenteritis. Scand J Infect Dis, 2014. 46(6): p. 462-5.
Blaskovich MA1, Butler MS2, Cooper MA2 .Essays Biochem. 2017 Mar 3;61(1):103-114. doi: 10.1042/EBC20160077.










