Starten på et nytt liv er mikroskopisk, men likevel så stor
Tekst: Trine Skuland, ingeniør og forskningsmedarbeider ved Reproduksjonsmedisinsk avdeling, oslo universitetssykehus.
«Det er ikke størrelsen som teller!» sies det ofte. Når det kommer til eggets størrelse derimot, kan det se ut til at dette spiller inn på hvorvidt et befruktet egg vil kunne gi opphav til et nytt individ.
Hvert tiende par i fruktbar alder er ufrivillig barnløse. Pågangen for assistert befruktning er stor, og Reproduksjonsmedisinsk avdeling ved Oslo Universitetssykehus utfører ca. 1700 statsstøttede behandlinger per år. Dette har resultert i over 10 000 babyer siden avdelingen ble etablert i 1984.

Avdelingen består av et tverrfaglig team med 11 embryologer/bioingeniører, 8 sykepleiere og 8 leger. Vi har også et stadig utvidende forskningsmiljø med 2 fulltids- og 6 deltidsforskere som jobber med forskning, utvikling og innovasjonsprosjekter.
Forsker for enda bedre IVF-behandling
En forskningsgruppe fra University of California har vist at det store volumet på befuktede egg og tidlige embryoceller fra rundormen C.elegans fører til svakere kontroll over celledelingen, noe som gir større sjanse for kromosomfeil.
«Ved hjelp av mikromanipulering reduserer vi størrelsen på befruktede egg fra mus for å undersøke om denne mekanismen hos rundormen er noe som også gjelder for pattedyr.

Vi ønsker å finne ut mer om årsaken til at mange embryo ikke fører til graviditet eller fullførelse av svangerskap og vellykket fødsel. Forhåpentligvis vil dette i fremtiden kunne bidra til forbedring av resultatene ved assistert befruktning.»
Dette sier klinisk laboratorieleder og forsker ved Reproduksjonsmedisinsk avdeling, Gareth Greggains.
Eggets finurlige natur
Visste du at eggcellen er den cellen i kvinnekroppen som har størst volum? Volumet er rundt 63 000 ganger større enn volumet av en sædcelle, og med sin diameter på ca. 0,1 mm er det akkurat mulig å se et egg med det blotte øyet.
Allerede fra 2. måned av fosterlivet starter utviklingen av eggceller hos jenter. Da begynner den prosessen som kalles meiose eller kjønnscelledeling.
Ved fødsel har eggenes utvikling stoppet midlertidig opp og gjenopptas først i starten av puberteten. Hver måned modnes normalt ett egg og eggets meiose fullføres ikke før en sædcelle klarer å befrukte det.
Dersom befruktning finner sted, resulterer eggets kjønnscelledeling i at zygoten har fått halvparten av kromosomene (23) fra mor, mens den andre halvdelen kommer fra farens sædcelle (Gilbert, 2000).
Det er mange faktorer som spiller inn på om et befruktet egg utvikler seg normalt og kan resultere i et nytt individ. Blant disse er viktige kontrollmekanismer som styres for eksempel vha. det som kalles epigenetikk – kjemiske merkelapper på DNAet eller på proteinene som DNAet er pakket rundt.
Les mer om dette i et tidligere innlegg av avdelingen vi samarbeider med: Livets ”software” – Et program skrevet i eggcellen styrer embryoutviklingen
Mennesker er ineffektive rent reproduksjonsmessig
Dersom alt går som det skal, vil det befruktede egget begynne å dele seg vha. vanlig celledeling, kjent som mitose, og dette gir datterceller med likt antall kromosomer (46) som det befruktede egget.
Det er en forutsetning at antallet kromosomer er riktig både i eggcellen og sædcellen som befrukter egget. Dersom antallet kromosomer ikke er riktig sier vi at cellen er aneuploid. Da vil også det resulterende embryoet være aneuploid og vil kanskje ikke kunne bli til en graviditet, eller det kan føre til spontanabort eller at barnet blir født med utviklingshemninger.
Faktisk er det slik at kun ca. 30 % av befruktede egg gir opphav til et nytt individ (Macklon et al., 2002).
Reproduksjon hos mennesker er på den måten ganske ineffektiv. Dette kommer mange ganger av aneuploidi i embryoet, noe som ofte skyldes feil i eggets meiose.
Forekomsten av slike feil øker betydelig i takt med kvinnens alder. Undersøkelser gjort på egg viser at kvinner under 25 år har 5 % aneuploidi.
Dette øker til 10-25 % for kvinner i tidlig 30-årene, mens det er over hele 50 % hos kvinner som er over 40 (Fragouli et al., 2011).
Aneuploide embryo kan også være et resultat av feil i mitosen – altså celledelingen som skjer etter befruktning. Dette ser man bevis for i en oversiktsundersøkelse som har sett på flere studier av overtallige embryo fra assistert befruktning.
Undersøkelsen kom frem til at 59 % av embryoene hadde såkalt diploid/aneuploid-mosaikk (Van Echten-Arends et al., 2011). Det vil si at kromosomantallet var riktig i noen celler (diploide), mens andre celler hadde for mange eller for få kromosomer.
Dersom feil bare hadde kunnet oppstå i eggets meiose, er det nærliggende å tro at alle cellene i det resulterende embryoet ville hatt samme kromosominnhold og man ville ikke sett disse mosaikk-embryoene.
Større er ikke alltid bedre
To kritiske hendelser er essensielle for embryoets utvikling; fordeling av kromosomer under mitose og epigenetisk reprogrammering. Spindelsamlingssjekkpunktet er et kontrollpunkt i cellesyklusen som skal sørge for at dattercellene får rett antall kromosomer ved deling.
En nyere studie som ble utført på embryo fra rundormen C.elegans viste at funksjonen til dette spindelsamlingssjekkpunktet fungerte dårligere i celler med stort volum (Galli et al., 2016).
Det viste seg at dette skyldtes lav kinetokor-til-cytoplasma-ratio i store celler. Kinetokor er et proteinområde på kromosomene hvor spindelfibrene, som deltar i den fysiske fordelingen av kromosomene under celledeling, fester seg. Cytoplasma er det væskeaktige innholdet i cellen som kjernen og organellene (cellens bestanddeler) ligger i.
Det store volumet til et befruktet egg fra C.elegans, og de første cellene i embryoet, førte til at signalene til spindelsamlingssjekkpunktet ble svakere. Dette vil kunne resultere i at cellen deler seg før alle kinetokorene er festet.
Kromosomene blir dermed ikke riktig fordelt til hver dattercelle og aneuploidi er et faktum.
Manipulering av befruktede egg
Vi er nå i ferd med å undersøke styrken til dette sjekkpunktsignalet i forhold til cellestørrelse i befruktede egg fra mus for å se om dette er en mekanisme som er bevart hos pattedyr.
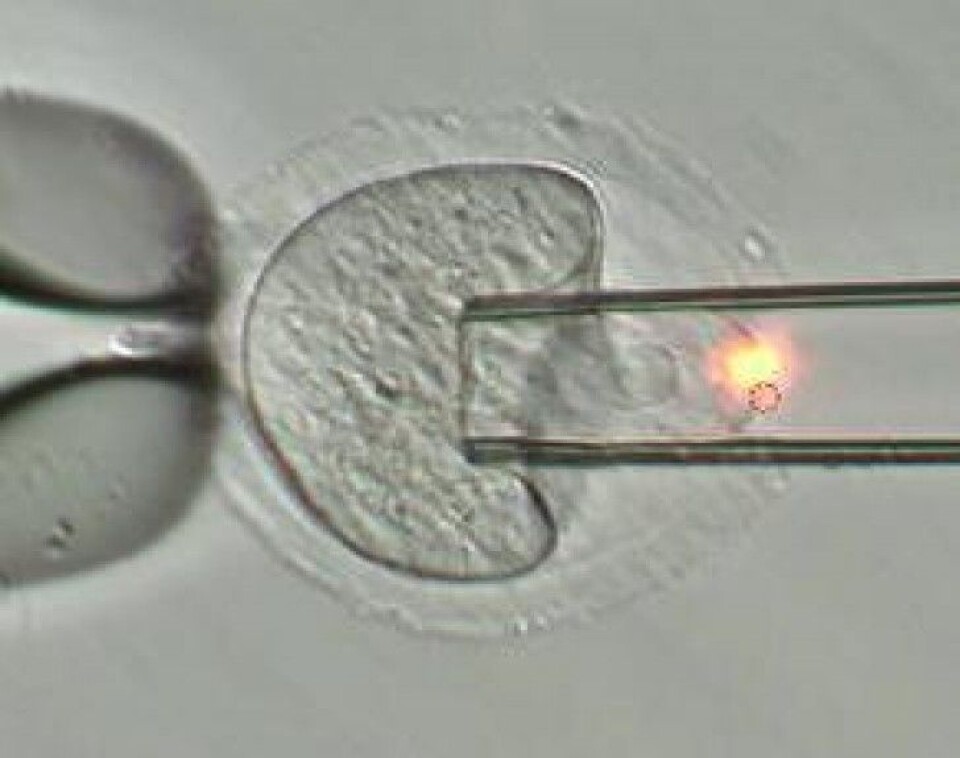
Vi benytter avanserte mikromanipuleringsteknikker for å redusere størrelsen på det befruktede egget.
Dette gjøres ved at egget holdes fast med en holdepipette mens man lager et lite hull i skallet, zona pellucida, som omgir egget vha. en medisinsk laser. Deretter føres en veldig tynn pipette (19 µm i diameter) inn i hullet og 1/3-1/2 av cellens cytoplasma suges ut, slik som vist på bildet under.
Videre overvåker vi utviklingen til de manipulerte embryoene vha. «time lapse»-mikroskopi for å se på tidsaspekter og cellenes størrelse.
Vi planlegger også å gjøre «live cell imaging» ved å farge relevante cellestrukturer slik at de avgir fluorescens og blir synlige vha. fluorescensmikroskopi.
Slik kan vi for eksempel se på hvordan kromosomene fordeler seg under utviklingen. I tillegg vil det være aktuelt å se på hvilke gener som uttrykkes på de ulike stadiene av utviklingen vha. såkalt RNA-sekvensering.
Da kan vi undersøke om genuttrykksprofilen er annerledes eller ikke i de manipulerte embryoene.
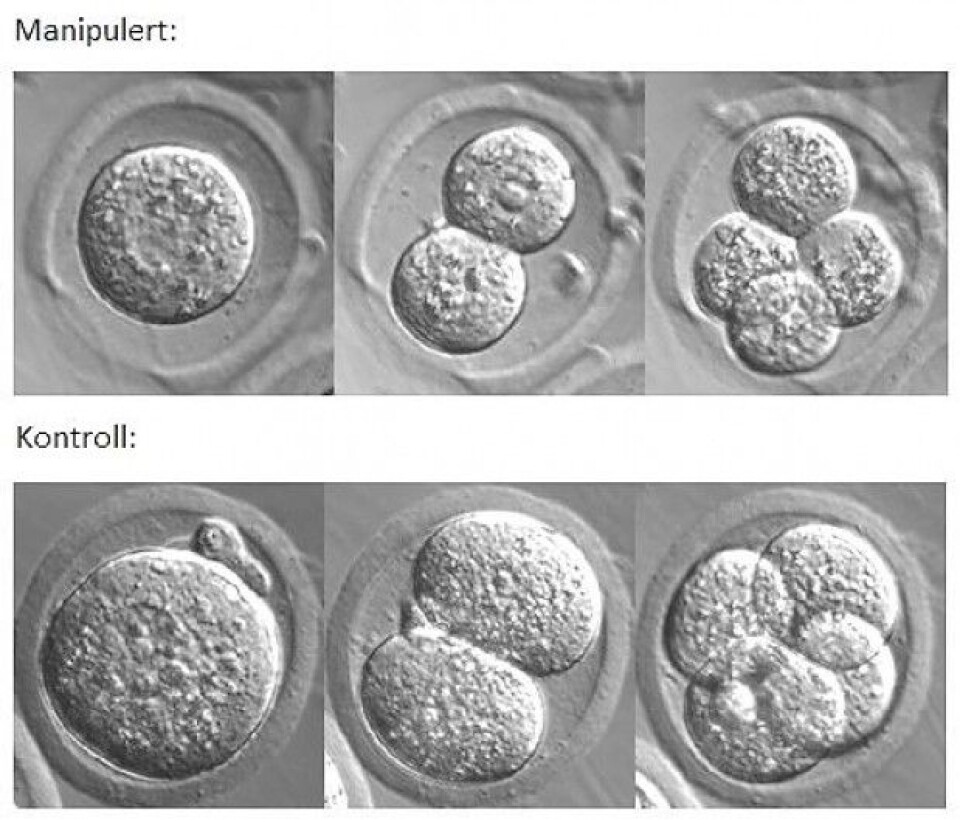
Målet med denne forskningen er å få en større forståelse av kontrollpunkter i cellesyklusen og svakhetene deres under tidlig embryoutvikling.
Reduksjon av cellestørrelse er et eksempel på en av metodene som forhåpentligvis vil bane vei for nye forskningsspørsmål vi kan bryne oss på.
Håpet er at vi til slutt ender opp med ny kunnskap som kan bidra til forbedring av resultatene innen assistert befruktning slik at det kan komme pasientene våre til gode.
Dette er en liten del av et større prosjekt med mål om å avdekke mer kunnskap rundt epigenetisk reprogrammering og utviklingskompetansen hos tidlige embryo.
Forskningen i dette overordnede prosjektet skal ikke bare betraktes fra et molekylærbiologisk ståsted, men også det etiske og sosiologiske knyttet til embryoforskning og assistert befruktning skal belyses.
Det vil si at det skal opprettes en tverrfaglig forskningsgruppe med samarbeid mellom vår avdeling (OUS), Klinikk for laboratoriemedisin (OUS), Institutt for filosofi, ide- og kunsthistorie og klassiske språk - Det humanistiske fakultet (UiO) og Institutt for helse og samfunn – Det medisinske fakultet (UiO).
Vi gleder oss til å se hva fremtiden vil bringe for dette konvergensmiljøet!
Referanser/kilder:
FRAGOULI, E., WELLS, D. & DELHANTY, J. D. 2011. Chromosome abnormalities in the human oocyte. Cytogenet Genome Res, 133, 107-118.
GALLI, M. & MORGAN, DAVID O. 2016. Cell Size Determines the Strength of the Spindle Assembly Checkpoint during Embryonic Development. Developmental Cell, 36, 344-352.
GILBERT, S. 2000. Developmental biology. 6th ed. Sunderland, Mass.: Sinauer Associates, Chapter 19: Oogenesis. Available from: https://www.ncbi.nlm.nih.gov/books/NBK10008/
MACKLON, N. S., GERAEDTS, J. P. & FAUSER, B. C. 2002. Conception to ongoing pregnancy: the 'black box' of early pregnancy loss. Hum Reprod Update, 8, 333-343.
VAN ECHTEN-ARENDS, J., MASTENBROEK, S., SIKKEMA-RADDATZ, B., KOREVAAR, J. C., HEINEMAN, M. J., VAN DER VEEN, F., REPPING, S. 2011. Chromosomal mosaicism in human preimplantation embryos: a systematic review. Hum Reprod Update, 17, 620-627.







