
Hundreårsjubileum for oppdagelsen av grunnstoff 72 – et nordisk bidrag
Obs! (Sub- og superscript-tall er ikke synlige i hovedteksten (bare i figurene). En PDF-fil med sub- og superskripter kan lastes ned fra denne linken)
Oppdagelsen av grunnstoffet med atomnummer 72, hafnium (Hf) ble rapportert av Coster & Hevesy i tidsskriftet Nature, 20. januar, 1923.
De fant grunnstoffet i det zirkonium-dominerte mineralet zirkon, og fordi oppdagelsen ble gjort i gruppen til Niels Bohr i København, ble det navngitt etter det latinske bynavnet, Hafnia.
Den berømte norske geokjemikeren, Victor M. Goldschmidt i Oslo fant også dette grunnstoffet i zirkon-prøver, og sammen med sin medforfatter, L. Thomassen, sendte de inn sin artikkel 29 dager etter København-gruppen.
Atomer og isotoper
Da Dimitri Mendeleev systematiserte de kjemiske egenskapene til grunnstoffene i forløperen til vårt periodesystem i 1869, var det flere «ledige ruter» i hans system. I 1922 var hafnium (72Hf) and rhenium (75Re) de to eneste gjenværende ledige rutene som senere skulle vise seg å inneholde stabile (ikke-radioaktive) grunnstoffer som det var mulig å finne i naturen.
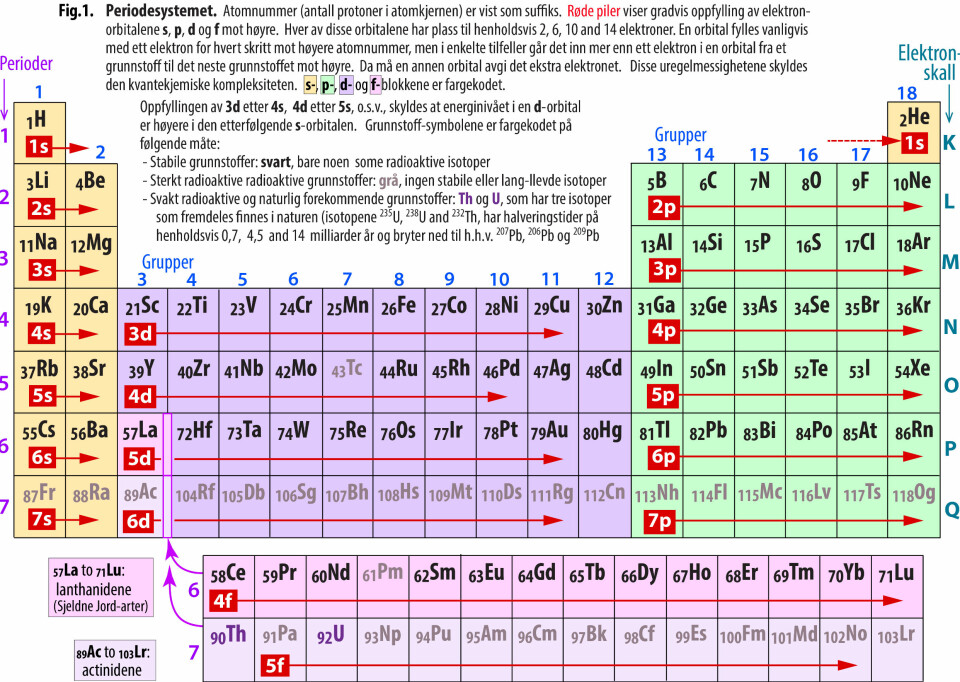
Dagens oppdaterte periodesystem er vist i Figur 1 (se under). Svein Stølen, som er professor i kjemi og nåværende rektor ved Universitetet i Oslo, la i 2007 grunnlaget for den interaktive siden: periodesystemet.no, som vedlikeholdes og videreutvikles av Kjemisk instititt, Univ. i Oslo. Der finnes flere ulike versjoner av periodesystemet og enkel informasjon om grunnstoffene.
Hvert grunnstoff er entydig bestemt av antallet protoner (positivt ladde partikler) i atom-kjernen. Alle grunnstoffene, unntatt vanlig hydrogen, har i tillegg et varierende antatt nøytroner (proton-lignende partikler uten ladning) i kjernen.
Den lille atomkjernen er omgitt av en mye større og mer fleksibel «sky» av elektroner. Antall protoner, hver med en ladning lik +1, angir atomnummeret, for eksempel hydrogen-1, oksygen-8 og hafnium-72. Vi skriver vanligvis atomnunmmeret som venstre-subskript, for eksempel 1H, 8O eller 72Hf.
Protonene og nøytronene har nesten identiske masser på henholdsvis 1.673 og 1.675 yocto-gram, mens elektronene, til sammenligning, er praktisk talt masseløse (0.0009 yocto-gram). Den totale atommassen er ganske lik summen av protonene og nøytronene i kjernen. Derfor har vanlig hydrogen uten et eneste nøytron en atommasse på 1.00794 og vanlig oksygen med 8 nøytroner i tillegg til 8 protoner en atommasse på 15.9994.
Antallet nøytroner i kjernen øker forholdsmessig mye når en beveger seg mot høyere atomnummer fordi nøytronene «fortynner» ladningen i kjernen, slik at den ikke sprenges av indre elektrostatisk frastøtning. Vanlig helium med 2 protoner og 2 nøytroner har derfor like mange protoner og nøytroner og en atommasse på cirka 4, mens vanlig uran med atomnummer 90 har 1.6 ganger så mange nøytroner (148) og dermed en atommasse på cirka 238.
Grunnstoffene, og særlig de tyngste, har vanligvis mange ulike isotoper, det vil si atomkjerner, alltid med samme antall protoner, men med ulike antall nøytroner.
Mange av disse isotopene kan være litt eller svært ustabile, det vil si svakt eller sterkt radioaktive, og de kan ha halveringstider fra mikrosekunder og sekunder til mer enn 100 milliarder år. Halveringstiden er den tiden det tar før halvparten av den opprinnelige mengden, produsert i en stjerne eller en kjernefysisk reaktor, er nedbrutt.
Hafnium med atomnummer 72 har 46 isotoper, hvorav 6 er stabile. De stabile eller meget svakt radioaktive isotopene 174Hf, 176Hf, 177Hf, 178Hf, 179Hf, 180Hf (med halveringstider på mer enn 500 millioner år) utgjør henholdsvis 0.2, 5.3, 18.6, 27.2, 13.6 og 35.1 prosent av vanlig jordisk hafnium.
Vi skriver massetallet (=protoner+nøytroner) for de ulike isotopene som superskript til venstre, i motsetning til atomnummeret, subskript nede til venstre (Dette er kun synlig i den lenkete PDF-filen, se adressen helt øverst i artikkelen).
Hf har også 4 svakt radioaktive isotoper med halveringstider mellom 500 millioner år og 30 dager. Seks av isotopene har halveringstider på mellom 30 dager og 10 minutter, mens de øvrige 30 isotopene med massestall under 168 og over 184, samt massetall 169, er høy-radioaktive med halveringstider på mindre enn 10 minutter.
Periodesystemet og elektron-strukturen rundt atomkjernene
I periodesystemet (Fig. 1) øker atomnumrene i periode 1 fra 1H øverst til venstre til 2He øverst til høyre. Deretter fylles systemet opp med periodene 2-7, fra venstre mot høyre. Periodene 6 og 7 inneholder innskudd av 2 ganger 14 grunnstoffer som kalles lantanidene (sjeldne jordarter) fra 57La til 71Lu og actinidene fra 89Ac til 103Lr.
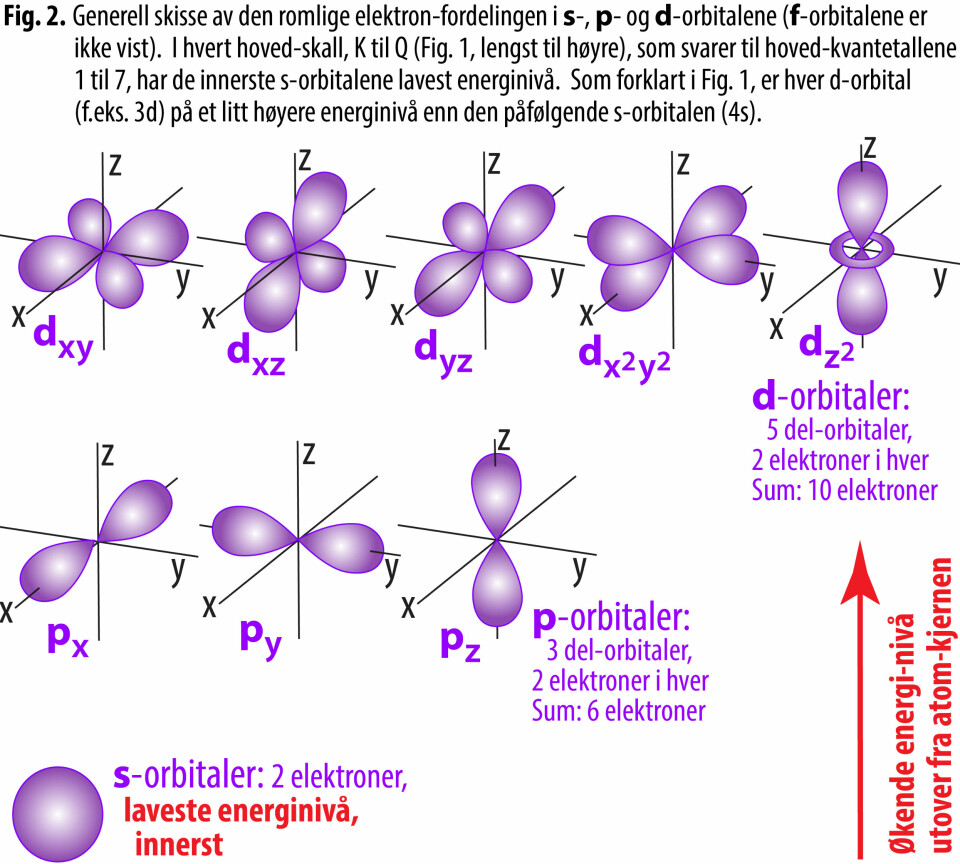
Som vist i Fig.1, fylles elektron-orbitalene s, p, d og f opp i en bestemt rekkefølge. Fig. 2 er en generell romlig skisse i et xyz-koordinatsystem som viser sannsynlig fordeling av elektronene i de tre innerste orbitalene s, p og d.
Elektron-strukturen rundt atomkjernen er bestemt av kvantekjemiske lover, uttrykt ved Schrödinger-ligningen. Den omfatter fire delfunksjoner knyttet til hvert sitt «kvantetall». Kvantetallene er knyttet til energinivåene for de ulike elektron-orbitalene og rekkefølgen for oppfylling av orbitalene med elektroner.
De 7 elektronskallene K, L, M, N, O, P, Q, svarer til hoved-kvantetallene og periodene 1-7, fra det laveste energinivået innerst nær atomkjernen, til høyest energi ytterst i de største atomene. De 7 skallene er vist lengst til høyre i Fig. 1.
Strukturen av elektron-orbitaler som er knyttet til de fire ulike kvantetallene, gir kun den sannsynlig romlige fordelingen av elektroner. Dette har sammenheng med Heisenbergs usikkerhetsprinsipp, som sier at posisjon og bevegelsesmengde for partikler, for eksempel elektroner, ikke kan måles samtidig.
Bakgrunn for oppdagelsen av
grunnstoff 72
I 1912 oppdaget Max van Laue at røntgenstråler avbøyes av krystaller. Den unge fysikeren Henry Moseley (1887-1915, doktorgrad fra Universitetet i Oxford i 1910), arbeidet da i forskningsgruppen til Ernest Rutherford ved Universitetet i Manchester.
Moseley skjønte umiddelbart at han kunne bruke oppdagelsen til Laue for å kartlegge den induserte (flourescente) røntgenstrålingen som er karakteristisk og unik for hvert av grunnstoffene når de bombarderes med konsentrerte elektronstråler.
Han bygget et røntgenspektroskop og undersøkte alle grunnstoffene fra aluminium (13Al) til gull (79Au). Resultatene ble publisert i to artikter i Philosophical Magazine i 1913 og 1914, som la vekt på at den karakteristiske røntgenstrålingen fra hvert enkelt grunnstoff var entydig koblet til atomnummeret. I tabellen hans med grunnstoffene fra atomnummer 13 til 79 manglet atomnummer 43, 61, 75 og egentlig også 72.
Den franske geokjemikeren Georges Urbain (1872-1938) trodde imidlertid at han allerede hadde oppdaget grunnstoff 72, som han kalte celtium. Urbain var imponert over arbeidet til Moseley og besøkte ham i juni 1914. Han hadde med seg prøver av sine celtium-separater, som Moseley umiddelbart undersøkte og fant at de var blandinger av de to tyngste lantanidene, ytterbium (70Yb) og lutetium (71Lu).
Kort tid etter dette brøt første verdenskrig ut. Moseley gikk inn i den Britiske hæren som sambandsmann i ingeniørvåpenet. Ernest Rutherford anmodet om at Moseley, på grunn av sitt vitenskapelige talent, måtte bli overført til National Physics Laboratory.
Anmodningen ble tatt til følge, men dette skjedde for sent, siden Moseleys avdeling allerede var overført til kampene ved Gallipoli. Moseley ble drept av en tyrkisk snikskytter 19. august, 1915.
Nordisk leting etter grunnstoff 72
Letingen etter grunnstoff 72 ble trappet opp i 1922, i forskningsgruppene til Niels Bohr i København og Victor M. Goldschmidt i Oslo.
Fordi atomnummer 72 er i gruppe 4 mellom de treverdige lantanidene (57La to 71Lu, som danner ioner med 3+ ladning) og fem-verdig tantal (73Ta), samt rett under fireverdig zirkonium (40Zr), fokuserte begge gruppene på norske prøver av mineralet zirkon, med sammensetning nær ZrSiO4.
Gruppen til Bohr brukte norske zirkon-prøver i Geologisk museum i København, mens Goldschmidt, som arbeidet ved Geologisk Institutt og litt senere ved Mineralogisk-Geologisk Museum, Universitetet i Oslo, hadde rikelig med eget zirkon-materiale.
Begge gruppene hadde utviklet og bygget røntgen-sprektrometre og påviste grunnstoff 72 med cirka 29 dagers mellomrom. Coster og Hevesy i Bohr-gruppen sendte sin artikkel til Nature 2. januar, 1923 (ble publisert 20. januar) og ga grunnstoffet navnet hafnium etter det latinske navnet for København (hafnia). Goldschmidt og Thomassen sendte en artikkel med sine bekreftende resultater til Norsk geologisk tidsskrift 31. januar.
Før røntgen-analysen, konsentrerte Coster og Hevesy zirkonium og hafnium ved å koke pulverisert zirkonmateriale i syre og deretter fjerne den silika-rike syre-løsningen. En fullstendig separasjon av Hf fra Zr er vanskelig, og fordi Hf stort sett alltid opptrer som et bi- eller spor-stoff i zirkonium-rike mineraler, klassifiserte Goldschmidt Hf som et «kamuflert» grunnstoff.
Til tross for at Hf har mye høyere atomnummer (72) enn Zr (40), er Hf-atomet og Hf4+-ionet litt mindre (hhv. 1.1 og 1.6 prosent) mindre enn Zr-atomet og Zr4+-ionet. Dette gjør at Hf passer utmerket inn i Zr-posisjonene i Zr-dominerte mineraler som zirkon.
Grunnen til at det tunge Hf-atomet og Hf4+-ionet er så lite, har sammenheng med den såkalte lantanide-sammentrekningen. De 14 elektronene i 4f-orbitalene fylles gradvis og systematisk opp med økende atomnummer fra 58Ce to 71Lu. Disse 4f-elektronene gir imidlertid dårlig skjerming av den økende positive kjerne-ladningen med økende atomnummer mot 71Lu.
Dette fører til at de ytterste elektronene i de svært ufullstendige O- og P-skallene trekkes effektivt innover slik at atom- og tilsvarende ionestørrelse reduseres litt i takt med økende atomnummer.
Leting etter grunnstoffene 75, 43, 61
I ettertid viste det seg at hafnium-oppdagelsen i 1923 representerte det nest siste funnet av stable grunnstoffer. Grunnstoff 75, rhenium, oppkalt etter Rhinen, ble oppdaget 2 år senere av Noddack and Tacke (1925). Lenge før det, i 1908, lette Masatake Ogawa, etter grunnstoff 43, i periode 5, gruppe 7.
Han trodde at han hadde funnet det, og kalte det nipponium, etter Japan. I virkeligheten var det rhenium (75Re) rett nedenfor, i gruppe 7, han hadde funnet. Denne historien er presentert av Hisamatsu et al. (2022).
Grunnstoff 43, som nå kalles technetium (Tc) etter den greske betegnelsen for «kunstig», har bare radioaktive isotoper med maksimal halveringstid på cirka 4 millioner år. Tc finnes derfor ikke i naturlige materialer.
Goldschmidt var svært skuffet over at han tapte kappløpet for å påvise grunnstoff 72Hf (Mason 1992). Han brukte mye tid og krefter på leting etter grunnstoff 61 i lantanide-serien (sjeldne Jordartselementer), basert på den store samlingen av lantanide-rike mineraler i Mineralogisk-Geologisk Museum i Oslo.
Etter cirka 10 år innså han at grunnstoffet sannsynligvis ikke hadde stabile isotoper. Dette ble bekreftet i 1945 da 61Pm (promethium) ble oppdaget i fisjons-produkter av uran som ble bestrålet i en grafitt-reaktor ved Oak Ridge National Laboratory i Tennessee (Marshall and Marshall, 2016).
Teknologisk og geokjemisk anvendelse av hafnium
Høyt smeltepunkt, korrosjons-motstand, evne til å bremse og fange nøytroner og gode mekaniske egenskaper gjør hafnium egnet til bruk i kontrollstaver i kjernefysiske reaktorer.
Hf brukes også som legerings-metall sammen med titan, niob, tantal og jern, i første rekke for å heve smeltepunkt og korrosjonsmotstand i slike legeringer. De relativt store utfordringene knyttet til ekstraksjon av Hf fra Zr-dominert metall har imidlertid begrenset de teknologiske Hf-anvendelsene.
Hafnium spiller viktige kosmokjemiske og geokjemiske roller i en kortlevet og en langlevet radioaktiv nedbrytning: 182Hf til 182W med halveringstid på 9 millioner år og176Lu til 176Hf med halveringstid på 36 milliarder år.
Mengdeforholdet mellom disse foreldre- og datter-isotopene i ulike deler av Jordas kjerne, mantel og skorpe, samt de svært ulike halveringstidene, gir oss to utmerkete isotop-kjemiske analyseverktøy for å forstå:
(1) Planet-vekst og dannelse av metallkjerner i Jorda, og de andre Jord-lignende planetene i solsystemet vårt.
(2) Utvikling av Jordas skrope og mantel gjennom 4.4 milliarder år.
Fordi denne forskningen har utviklet seg parallelt med utviklingen av forbedrete massespektrometre i løpet av de siste tre tiårene, kunne ikke geokjemikeren Goldschmidt ha forutsett hvor viktig hafnium skulle bli i moderne kosmokjemi og geokjemi.
Videre lesning og referanser:
- Coster, D., Hevesy, G., 1923. On the missing element of atomic number 72. Nature 111, 79.
- Goldschmidt, V.M., Thomassen, L., 1923. Das Vorkommen des Elements No. 72 (Hafnium) im Malakon und Alvit. Norsk geol. tidsskr. 7, 61-68.
- Hisamatsu, Y., Egashira, K., Maeno, Y., 2022: Ogawa’s nipponium and its re‑assignment to rhenium. Found. Chem. 24, 15-57.
- Marshall, J.L, Marshall, V.R., 2016. Rediscovery of the elements. The rare Earths - the last member. Hexagon, Spring 2016, 4-9.
- Mason, B., 1992. Victor Moritz Goldscmidt: Father of Modern Geochemistry. Geochem. Soc. Spec. Publ. 4, Chapter 5. Intermezzo: The Search for Element 72.
- Moseley, H.J.G., 1913. The high-frequency spectra of the elements (1), Phil. Mag. 26, 1025-1034.
- Moseley, H.J.G., 1914. The high-frequency spectra of the elements (2), Phil. Mag. 27, 703–713.
- Noddack, W., Tacke, I., 1925. Die Ekamangane. Naturwissenschaften 13, 567-574.
- Rutherford, E., 1915. Henry Gwyn Jeffreys Moseley. Nature 96, 33-34.







