
Mer medisin til kreftsvulsten ved hjelp av ultralyd og mikrobobler
Fokusert ultralyd, gassfylte mikrobobler og nanopartikler med cellegift kan kurere kreft i mus og reduserer størrelsen på svulster i pasienter. Hvordan er dette mulig?
Til tross for store fremskritt innen kreftforskning de siste tiårene, er kreft fortsatt en ledende dødsårsak. En utfordring i behandling med cellegift er at cellegiften sprer seg til hele kroppen og skader de friske cellene, og svært lite når frem til svulsten. Ved å kapsle cellegiften inn i nanopartikler kan medisinen fraktes mer selektivt til svulsten, slik at bivirkningene reduseres.
Dette oppnås fordi blodårene i svulsten har porøse vegger, i motsetning til friske blodårer, slik at nanopartiklene kan lekke ut av blodårene. Problemet er at nanopartiklene bare når ut til de kreftcellene som er nærmest blodårene (se bilde 1).
For at behandlingen skal være effektiv, er det avgjørende at cellegiften når ut til alle kreftcellene i hele svulsten. Nanopartikler har en diameter i størrelsesorden ti til noen hundre nanometer, og har problemer med å nå fram til alle cellene i en svulst.
Om de skal lykkes å nå fram og drepe kreftcellene avhenger av at det er et godt utviklet blodårenettverk i svulsten, at nanopartiklene kan passere over kapillærveggen og at de er i stand til å trenge gjennom rommet mellom kreftcellene (kalt ekstracellulær matrix), bli tatt opp i cellen, frigjøre cellegiften fra nanopartikkelen slik at cellegiften kan drepe kreftcellen.
Det er altså mange barrierer som må overvinnes for å oppnå en vellykket behandling.
Hvordan virker ultralyd?
Ultralyd rettet mot svulsten gitt i kombinasjon med injeksjon av gassfylte mikrobobler i blodårene er vist å forbedre leveringen av nanopartikler og cellegift injisert i blodåren (bilde 1). Denne behandlingen kan også åpne blod-hjerne barrieren slik at legemidler kommer inn i hjernevev og både hjernesvulster og andre sykdommer i hjernen kan behandles.
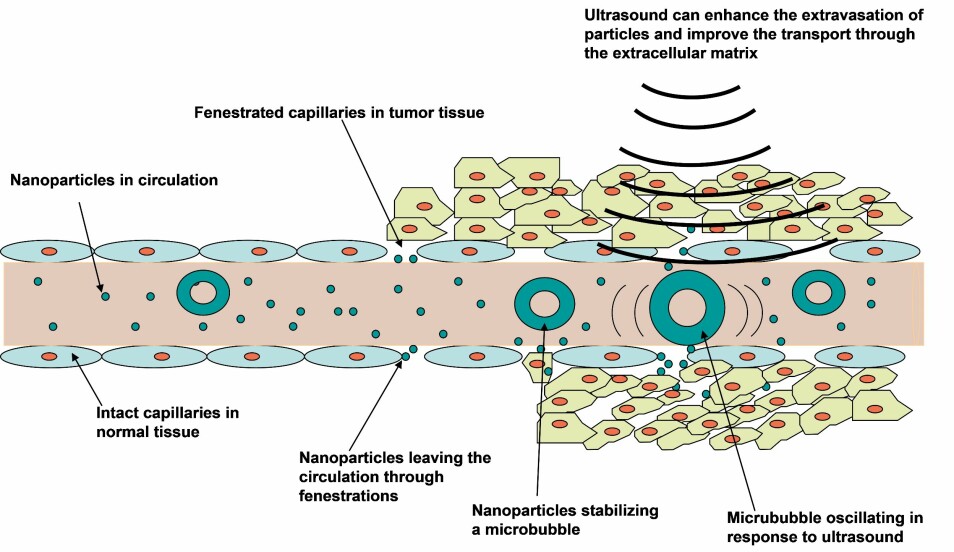
Mikrobobler brukes som kontrastmiddel for ultralydavbildning ved at mikroboblene absorberer energi fra og vibrerer i takt med ultralydbølgen og sender ekko tilbake som detekteres. Slike volumetriske vibrasjoner fra bobler i blodårene kan utnyttes til terapeutiske formål og da brukes ultralyd med andre frekvenser, pulslengder og/eller trykk.
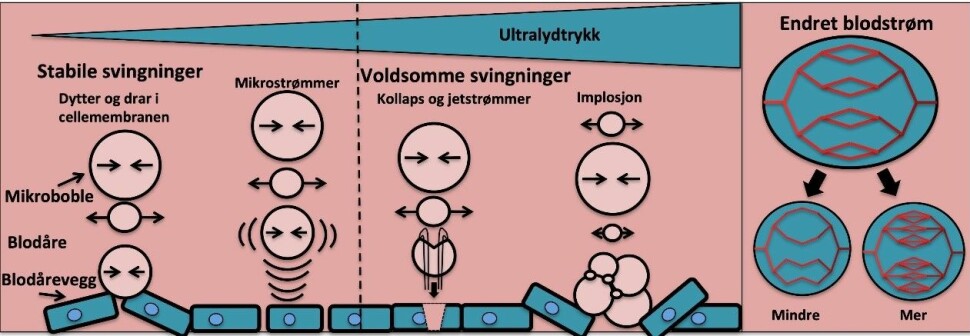
Vibrasjonene kan være rolige og kontinuerlige svingninger eller ha større svingninger og mer voldsomme utslag som fører til at boblen kollapser, som illustrert i bilde 2.
Den eksakte effekten dette har på omliggende vev og celler har man ennå ikke forstått fullstendig, men en rekke ulike effekter kan observeres. Det er vist at mikroboblene i ultralydfeltet kan danne åpninger mellom cellene i blodåreveggen, og dette er antatt å være den viktigste mekanismen for levering over blod-hjerne barrieren, og det kan dannes porer i cellemembranen.
I tillegg er det vist at man kan få endret blodgjennomstrømning i området som behandles med ultralyd, og både en økt og redusert blodstrøm er observert avhengig av ultralydfrekvens og trykk.
En spekulerer også i at ultralyd og de vibrerene mikroboblene danner væskestrømmer i ekstracellulær matrix som bidrar til at nanopartikler og cellegift mer effektivt transporteres ut til alle cellene i svulsten.
Mer kunnskap om mekanismene er nødvending
For å kunne optimalisere ultralydbehandlingen er det avgjørende å forstå mekanismene bak de lovende terapeutiske effektene som er oppnådd både i forsøksdyr og i pasienter. Ved CIUS/Inst for fysikk ved NTNU har vi derfor etablert en metode for å kunne mikroskopere og avbilde kreftvev gjennom et vindu i mus mens vi eksponerer svulsten for fokusert ultralyd. Kreftvev gror på ryggen på mus i et kammer med et vindu. Musene plasseres under et objektiv i et to-fotonmikroskop.
Mikrobobler og nanopartikler med et fluorescerende fargestoff injiseres i blodet og svulsten eksponeres for ultralyd. Dette gjør det mulig for oss å direkte kunne observere hva som skjer med nanopartiklene under og etter ultralydbehandlingen. For å se blodårene tydelig, injiserer vi også et fluorescensmerket makromolekyl (dextran-FITC) i blodbanen. Videoen viser hva som skjer i løpet av 5 min med ultralydbehandling. Videoen er avbildes 10 ganger raskere enn opptaket. Den grønne fluorescensen er det fluorescerende makromolekylet som visualiserer blodårene. Den røde fluorescensen er nanopartiklene. Videoen viser at blodstrømmen endrer hastighet og retning.
Ved ulike tidspunkt observeres eksplosjons-liknende hendelser der nanopartikler og makromolekyler skytes ut av blodårene og inn i det omkringliggende vevet. Eksplosjonene ser voldsomme ut, men analyser av vevet viste ingen større blødninger. Vi observerte at eksplosjonen skjedde i forgreiningspunkter av blodårene, og vi fant at mindre blodårer trengte høyre ultralydtrykk for å få en eksplosjon enn blodårene med større diametere.
Denne mikroskoperingen i virkelig tid under ultralydeksponering er et verdifullt verktøy for å få ny kunnskap om mekanismene for den nye lovende behandlingsformen.








